Сирек элементтер. Ниобий және тантал
Оңтүстік Қазақстан обылысы
Шардара ауданы
№ 16 колледж
Орындаған: Тұ-43 топ студенті Қайырбек Ұлдана Асылханқызы
Жетекшісі: Айтенова Нұргул Ыдырысқызы
Жоспар:
1. Тарихи мағлұматтар
2. Физикалық және химиялық қасиеттері
1. XVII ғасырда Солтүстік Америкада қара түсті слюданың алтын сызықтары бар минералы ашылған. Оны Англияға жібереді, бұл минерал Британ музейінде 150 жыл жатты. 1801 жылы химик Хатчет осы минералды зерттеуге кірісіп, құрамынан темірді немесе қышқылды оксидтің қасиеті бар белгісіз затты тапты. Бұл жаңа элементті колумби, ал минералды колумбит (минералды тапқан жер – Колумбия – Америка) деп аталады.
1802 жылы швед зеттеушісі Экеберг кейбір скандинав және фин минералдарында тағы жаңа зат тапты, оны тантал деп атады. Бұл атау грек философиясындағы – Тантал белгісіне қойылған, себебі жаңа элемент қышқылдарға тұрақтылығын көрсетеді. Тантал қасиеттері колумбидің қасиеттеріне өте жақын болып шықты, сондықтан көп ғалымдар колумбий мен тантал бір элемент деп санап жүрді.
Хатчет пен Экеберг танталдың және колумбийдің қоспасын ашты, бірінші-сінде - колумбийдің, екіншісінде - танталдың мөлшері көбірек болды.
1884 жылы Розе бір минералда екі элементті — тантал мен колумбийді тапты, оны ниобий деп атады (Ниобея — Танталдың қызы).
1865 жылы Мариньяк танталдың және ниобийдің қасиеттерін зерттеген-де металдарды бір-бірінен фторидті әдіспен бөлді. Таза тантал бірінші рет тек қана 1903 жылы, ал таза ниобий — бүдан да кейінірек алынған.
2. Тантал мен ниобий ванадий сияқты периодтык, жүйенің бесінші тобына кіреді. Бірақ ниобий, әсіресе тантал ванадиймен салыстырғанда өте ауыр тотықсызданады. Сондықтан тәжірибеде бес валентті қосылыстармен жұмыс істеледі. Атомдарының электрондық құрылысы: ниобий — 2, 8, 18, 12, 1; тантал — 2, 8, 18, 32, 11, 2.
1 кесте
Элементтердің негізгі сипаттамалары:
Тантал мен ниобийдің химиялық қасиеттері өте ұқсас, олар табиғатта бірге кездеседі, сондықтан оларды бір-бірінен бөлу өте қиын.
Сыртқы түріне қарағанда ниобий және тантал металы платинаға ұқсас.
|
Сипаттамалар |
Ниобий |
Тантал |
|
Реттік номірі |
41 |
73 |
|
Атомдык, салмагы |
92.91 |
|
|
Тығыздык, |
- |
16,6 |
|
Атомының радиусы, А° |
1,46 |
1,46 |
|
Бес валентгі ионның радиусы, А° |
0,69 |
0,69 |
|
Электр кедергісі, ом |
15.22 10 5 (0“С) |
13,5-10'6 (20°С) |
|
К,айнау температурасы, °С |
4822 |
5292 |
|
Балку температурасы, °С |
2497 |
2997 |
Металдардың физика-механикалық қасиеттері өте жоғары, бірақ бұл қасиет-тер металдардың тазалығына байланысты.
Металдардың ең бағалы қасиеттері - қышқылдарға тұрақтылығы жоғары, олар концентрлі азот және патша қышқылдарында ерімейді.Тантал өте тұрақты. Бұл қасиеттер 2 кестеде ниобий мен танталдың әр түрлі қышқылдарда корроииясының мәліметтерінен көрініп тұр.
2 кесте
Ниобий мен танталдың қышқылдардағы коррозиясы
|
Ертінділер |
Ниобий |
Тантал |
|||||
|
Тем-пера-тура, 0С |
Тәжі-рибе ұзақ-тығы, күн |
Корро-зия жылдам-дығы, мг/дм2 күн |
Темпе-ратура, 0С |
Тәжі-рибе ұзақ-тығы, күн |
Корро- зия жыл-дамды-ғы, мг/дм2 күн |
||
|
Концентірлі тұз қышқылы |
100 |
82 |
23,4 |
19-26 |
135 |
0,0 |
|
|
21 |
67 |
0,6 |
|
|
|
||
|
Концентірлі азот қышқылы |
100 |
67 |
0,0 |
19-26 |
135 |
0,0 |
|
|
Концентірлі күкірт қышқылы |
50 |
67 |
4,8 |
19-26 |
135 |
0,0 |
|
|
175 |
1 |
үлгі толық ериді |
175 |
30 |
1,4 |
||
|
300 |
3 сағат |
3960,0 |
|||||
|
“Хром қоспасы” |
100 |
42 |
46,4 |
19-26 |
135 |
0,0 |
|
|
Қымыздық қышқылының қаныққан ерітіндісі |
21 |
82 |
3,3 |
96 |
90 |
0,1 |
|
|
85%-ті фосфор қышқылы |
100 |
31 |
19,3 |
145 |
90 |
0,05 |
|
|
21 |
82 |
0,07 |
|
|
|
||
Кестеден қыздырғанда күкірт қышқылы ниобийді толық, ал танталды аздап ерітетінін көруге болады. Екі металл азотжәне фосор қышқылдарының қоспаларында ериді, бөлек фтор қышқылы ниобийге жай әсер етеді, ал танталға әсер етпейді. Тапталдың қышқылдарға жоғары тұрақтылығы кон-центрлі азот-, бром-, тұз қышқылдарын, сүйытылған бромды буландырғанда, ыдыс жасағанда пайдаланылады. Сілті ерітінділерінің ниобийге аздап әсері бар, ал танталға әсері жоқ. Ниобий мен тантал балқыған сілтілермен әрекет-тесіп, тұздар ниобаттар және танталаттар түзеді. Кез келген тұздардың бал-қымалары меи органикалық қосылыстары ниобий мен танталға әсәр стпейді.
Ниобий мен танталдың басқа маңызды қасиеттері: газдарды — сутекті (1 сурет), оттекті (9 сурет), азотты және т.б. сіңіруі. Бұл екі металл гидридтер түзеді: NbН, Та2Н, ТаН. Ниобий мен тантал оттекті 0,8%-ке дейін ерітеді:
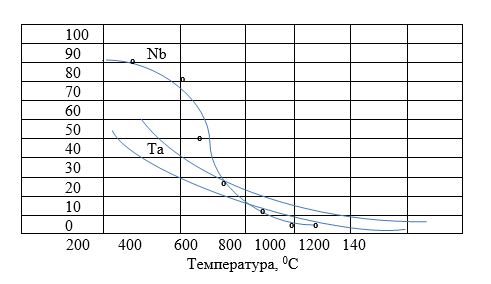
1 сурет - Тантал мен ниобийдегі сутек ерігіштігінің температурадан тәуелділігі
Ниобий мен тантал көп металдармен құймалар береді, көбінесе олардың бағалы қасиеттері бар, сондықтан тәжіри беде маңызы зор.
2 суретте металдағы оттек мөлшерінен оның электр қарсылығының тәуелділігі көрсетілген.
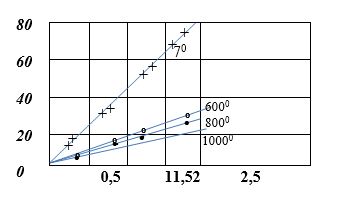
2 сурет - Металдағы оттек мөлшерінен оның электр қарсылығының тәуелділігі
Оттекпен қосылыстары
Ниобий мен тантал қышқылды қасиеттері бар оксидтер түзеді. Бірақ табиғатта өздері қышқылдардың тұздары түрінде кездеседі, сондықтан ұзақ уақыт бойы оларды — “жер қышқылдары” немесе “ащы жерлер” деп атап жүрді.
Ниобий (V) мен танталдың (V) оксидтері Nb2О5 және Tа2O5- ақ түсті, ұсақ кристалл ұнтақтар, суда ерімейді, баяу балқиды. Ұнтақ ниобий металы 400°С температурада оттекте жанып оксид түзеді:
4Nb +5O2 →400° 2НЬ2O5.
Nb2O5 1150°С температуралы вакуумда диссоциацияланады:
Nb2O5 →1150° 2NЬO2 +½ O2 .
Тантал оксиді тантал металын қыздыру арқылы алынады (ниобийге ұқсас).
Ниобий мен танталдың оксидтері суда ерімейді, бірақ ең соңғы жұмыстарда олардың суда аз болса да еритіндігі көрсетілген: Nb2O5 -тің суда ерігіштігі — 1793 мг/мл, ал Та2O5 - 162 мг/л (3 сурет).
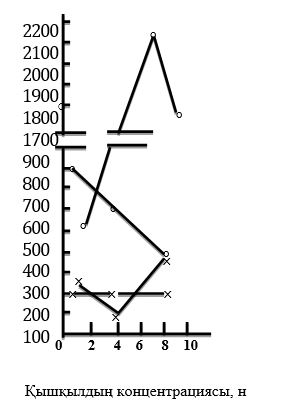
3 сурет - Ниобий мен тантал оксидтерінің қышқылдарда ерігіштігі:
1 - ниобий оксидінің тұз қышқылында;
2 - тантал оксидінің тұз қышқылында; 3
3 - ниобий оксидінін күкірт қышқылында;
4 - тантал оксидінің күкірт қышқылында Nb2O5 сутекпен немесе көміртекпен 1200-1300°С температурада тотықсыздандырғанда ниобийдің төменгі оксидтері алынады: Nb3O5, Nb2O3, Nb2O, NbO2, NbO.
Ниобий (IV) оксиді NbO2немесе Nb2O4 қара-көк түсті зат, ауада тұрақты, 850°С температурада қыздырғанда тотығып, ниобий оксиді Nb2O5 түзіледі. Төменгі оксидтердің тәжірибелік маңызы жоқ. Танталдың төменгі оксидтері тұрақсыз, қыздырғанда оңай тотығады.
Ниобий мен танталдың оксидтері конңентрациясы әр түрлі тұз және күкірт қышқылдарында ериді. Ерігіштіктері оксидтердің күйдіру температурасына байланысты.
Мысалы, 400°С температурада тұз қышқылында күйдіргенде Nb2O5 жақсы ериді, ал Та2O5 — 800°С температурада күйдіргенде - жақсы ериді. Оксидтер тұз қышқылымен әрекеттескенде — хлороксидтер, формуласы МеОС13, ал күкірт қышқылында ион МеО3+ түзеді:
Nb2O5 + 6НС1 → 2NbОС13 + ЗН2O;
Nb2O5 + ЗН2SO4 → (NbО3)2+(SO4)3 + ЗН2O.
Әдебиеттер тізімі:
1. Ферсман А.Е. Редкие металлы. 1932, № 4-5.
2. Сажин Н.П., Меерсон Г.А. Редкие элементы в новой технике // Хим. наука и пром., 1956. Т.І, № 5.
3. Меерсон Г.А. и Зеликман А.Н. Металлургия редких металлов. Метиаллургиздат, 1954.
4. Зеликман А.Н., Самсонов Г.В., Крейн О.Е. Металлургия редких металлов. Металлургиздат, 1954.
5. Тронов В.Г. Кклад русских ученых в химию редких элементов. Изд. Знание, 1952.
6. Виноградов А.П. Геохимия редких и рассеянных химических элементов в почвах. Изд. АН СССР, 1950.
Әлеуметтік желілерде бөлісіңіз:
Пікірлер (0)
Пікір қалдырыңыз
Қарап көріңіз
Басқа да жазбалар
- Жаңылтпаш
- Интернет немесе газет: цифрлық дәуірдегі ақпарат үшін шайқас
- Мәдениет - Қазақ елінің рухани құндылықтарының қазынасы
- Қазақ ұлттық университетінің жетістіктері
- Өнер-білім бар жұртта…
- Сайып қыран саралаған "Жаңа кітап" Мұхамеджан Сералин
- Қазақстанға жер аударылған халықтар тарихы
- Тілдік өзгерістер: Қазақ тілі мемлекеттік рәміз ретінде
- Заманауи мәдени құбылыстарды зерттеудің жаңа теориялары
- Бүгінгі қазақ кинематографиясынан жаңалықтар
- Қазіргі қоғамдағы метамодернизм көрінісі
- «Масс-медиа туралы» заң жобасын білесіз бе?
- Құрылымдық талдау және оның басты принциптері
- Место жетыгена в казахской музыкальной культуре
- Дене шынықтыру



- Альфред Адлер
- Альфред Адлер
- Альфред Адлер
- Альфред Адлер
Барлық авторлар
Ілмек бойынша іздеу
Мақал-мәтелдер
Қазақша есімдердің тізімі